194. Tutto quello che avresti voluto sapere sul PFO e sulla malattia da decompressione, ma eri troppo impegnato a decomprimere per chiedere…
|
di Doug Ebersole MD - Tratto da“InDepth” 1 marzo 2021 (Immagini per gentile concessione di Doug Ebersole) Sebbene le possibilità di malattia da decompressione (DCI) sia relativamente bassa, il rischio aumenta da 5 a 13 volte in presenza di un forame ovale pervio (PFO), che può allargarsi e diventare problematico con l'età. in questo articolo il cardiologo e istruttore di rebreather Doug Ebersole spiega le ultime ricerche in materia e cosa potrebbe significare il PFO per le immersioni. |
|
|
Il forame ovale pervio (PFO) è un argomento importante nell'immersione poiché l'apprezzamento del suo rapporto con la malattia da decompressione (DCI) cresce all'interno della comunità. Più di 1200 subacquei da tutto il mondo sono colpiti ogni anno da DCI. Sebbene l'incidenza di DCI sia relativamente bassa, variando da circa 1 episodio per 10.000 immersioni (0,01% per immersione) a circa 10 episodi per 10.000 immersioni (0,1% per immersione), a seconda della natura dell'immersione, la presenza di un PFO si ritiene che aumenti il rischio da 5 a 13 volte (rif. 1, 2, 3). Di conseguenza, la comprensione del legame tra PFO e DCI, così come le varie opzioni di trattamento, è di vitale importanza per i subacquei e per gli operatori sanitari che li trattano. |
|
Incidenza e anatomia
Un PFO è parte integrante della normale circolazione fetale. Normalmente, una parte del sangue dalla vena cava inferiore passa dall'atrio destro all'atrio sinistro attraverso il PFO durante la vita fetale, bypassando i polmoni. Alla nascita, il flusso sanguigno polmonare aumenta notevolmente, aumentando la pressione atriale sinistra. Le differenze di pressione atriale risultanti comprimono il setto primum contro il setto secundum, chiudendo funzionalmente il PFO. La chiusura anatomica del PFO si verifica più tardi nell'infanzia nella maggior parte delle persone, ma è incompleta in circa il 25% della popolazione (rif. 4, 5), lasciando questi individui a rischio di shunt da destra a sinistra.
I diametri dei PFO sono di dimensioni abbastanza variabili che vanno da 1-19 mm / 0,04-0,75 pollici, con una dimensione media maggiore negli anziani (rif. 4), suggerendo che i PFO possono continuare ad ingrandirsi durante la vita. La causa di ciò è sconosciuta, ma in parte può essere dovuta a noti aumenti della pressione del cuore destro con l'invecchiamento che causano la diminuzione della differenza di pressione tra l'atrio sinistro e l'atrio destro (che mantiene chiuso il PFO). Ciò può provocare PFO "più grandi" negli anziani.
|
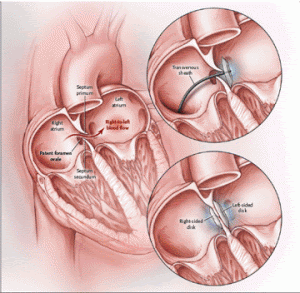
Disegno del cuore umano che mostra un forame ovale pervio |
|
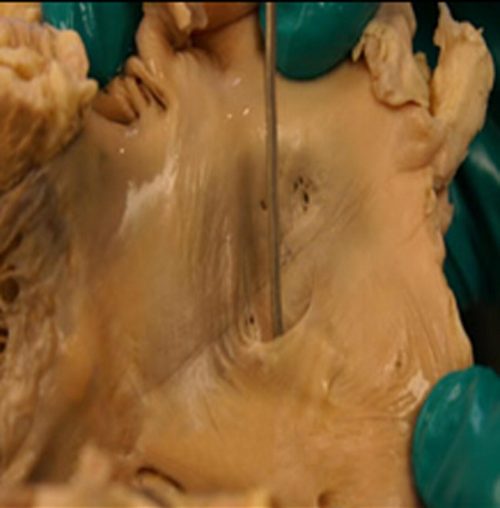
Campione di autopsia che mostra un forame ovale pervio |
I diametri dei PFO sono di dimensioni abbastanza variabili che vanno da 1-19 mm / 0,04-0,75 pollici, con una dimensione media maggiore negli anziani (rif. 4), suggerendo che i PFO possono continuare ad ingrandirsi durante la vita. La causa di ciò è sconosciuta, ma in parte può essere dovuta a noti aumenti della pressione del cuore destro con l'invecchiamento che causano la diminuzione della differenza di pressione tra l'atrio sinistro e l'atrio destro (che mantiene chiuso il PFO). Ciò può provocare PFO "più grandi" negli anziani. La relazione tra PFO e DCI
Nel 1986, è stato suggerito per la prima volta da Wilmhurst e colleghi che uno shunt cardiaco destro-sinistro può essere importante per un'embolia gassosa paradossale nei subacquei (rif. 6). Successivamente, l'importanza del PFO per la DCI nei subacquei è stata ulteriormente studiata (rif. 1,7,8, 9). Come accennato in precedenza, il rischio di DCI nei subacquei sportivi è piuttosto basso ma è aumentato di almeno cinque volte in presenza di un PFO (rif. 1, 2, 3). Inoltre, è stato riportato che il numero medio di lesioni cerebrali ischemiche osservato alla risonanza magnetica in subacquei esperti con PFO è doppio rispetto a quello nei subacquei senza PFO (rif. 11). L'eziologia e il significato clinico di questi risultati non sono chiari, ma possono rappresentare più eventi embolici paradossi subclinici attraverso il PFO. La diagnosi
Per la diagnosi e la valutazione del PFO sono stati utilizzati sia l'eco transtoracico (TTE), un'ecografia cardiaca eseguita dalla parete toracica, sia l'eco transesofageo (TEE), un'ecografia cardiaca eseguita dall'esofago. |
|
La TTE è considerata il test diagnostico preferito in quanto non invasivo. Tuttavia, data la sua migliore visualizzazione del setto atriale, il TEE, sebbene più invasivo, è molto più accurato del TTE e può essere utilizzato se, nonostante un TTE negativo, c'è ancora un alto indice di sospetto che il paziente abbia un PFO. Includere uno "studio delle bolle" con l'ecocardiogramma, TTE o TEE, aumenterà la probabilità di diagnosticare un PFO se è presente. Questo viene fatto collegando due siringhe di soluzione salina con una piccola quantità di aria con un rubinetto e quindi "agitando" le due siringhe avanti e indietro per "agitare" la soluzione salina, creando piccole "microbolle" che saranno visibili sull'imaging ecografico. La visualizzazione delle microbolle che passano dall'atrio destro a quello sinistro attraverso il forame ovale visualizzato è diagnostica di un PFO. Nella pratica clinica, il sito effettivo dello smistamento da destra a sinistra potrebbe non essere visualizzato o registrato in modo convincente per motivi tecnici. Se l'eco mostra microbolle che compaiono nell'atrio sinistro immediatamente dopo l'arrivo nell'atrio destro, si può presumere la presenza di un PFO. Da notare, mentre l'iniezione di "soluzione fisiologica agitata" viene eseguita di routine tramite una vena del braccio per comodità, è stato dimostrato che l'uso di una vena femorale nella gamba è più accurato (rif. 12-13). |
|
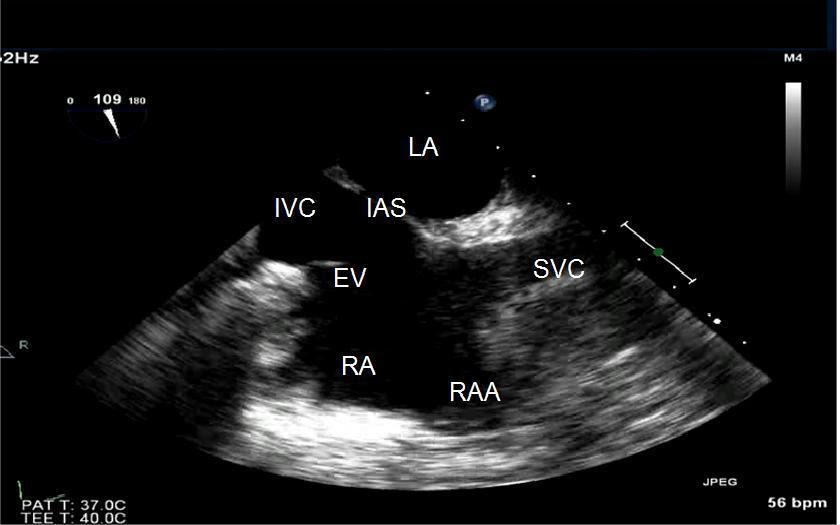
Immagine dell'ecocardiogramma transesofageo (TEE). LA = atrio sinistro, IAS = setto interatriale, IVC = vena cava inferiore, EV = valvola di Eustachio, RA = atrio destro, RAA = appendice atriale destra, SVC = vena cava superiore |
Opzioni terapeutiche
Non esistono linee guida specifiche per la chiusura del PFO nelle persone che hanno una malattia da decompressione, ma le opzioni possibili sono di interrompere le immersioni subacquee, di diminuire la profondità e/o il tempo delle immersioni per limitare il carico di gas inerte o di sottoporsi alla chiusura percutanea del PFO. Alcuni subacquei decidono di avere molti altri interessi e l'immersione in fondo non è così importante per loro. Questi subacquei in caso di PFO abbandoneranno lo sport.
Altri subacquei che amano lo sport ma si immergono raramente spesso optano per le immersioni "conservative" per limitare il loro carico di bolle. Ciò potrebbe comportare immersioni senza decompressione, limitazione della profondità a meno di 30 m/100 piedi, immersione con nitrox su profili d'aria, soste di sicurezza prolungate (superiori ai 3-5 minuti raccomandati) a circa 4-6 m/15-20 piedi alla fine delle loro immersioni e limitazione del numero di immersioni al giorno a una o due. I subacquei tecnici potrebbero anche scegliere di immergersi in modo più conservativo a seconda della loro tolleranza al rischio. |
|
Le persone che si guadagnano da vivere con le immersioni subacquee, ad esempio istruttori e divemaster, e subacquei tecnici che amano tipi di immersioni più aggressive come relitti profondi, immersioni in grotta, immersioni con rebreather e immersioni con miscele di gas spesso scelgono la chiusura percutanea del PFO. Questo vale anche per i subacquei che hanno avuto ricorrenti eventi DCI "immeritati" nonostante le immersioni conservative come sopra definito. I tipi di malattia da decompressione che sembrano essere associati al PFO includono cerebrale (sintomi simili a ictus), spinale (paralisi o ritenzione urinaria), cutanea (pieghe della pelle) e orecchio interno (vertigini). La DCI manifestata da dolore articolare NON è ritenuta associata e, pertanto, non dovrebbe richiedere una valutazione per il PFO. |
Risultati del trattamento
Un recente studio ha riportato i
risultati di pratiche subacquee conservative dopo un
episodio di DCI (rif. 14)Diciotto subacquei in questo
studio avevano uno shunt da destra a sinistra, 9 erano
piccoli e 9 erano grandi. Dopo aver seguito le raccomandazioni per le pratiche di immersione conservativa, il rischio DCI al follow-up è sceso a 6,0 per 10.000 immersioni nel gruppo con lo shunt piccolo e zero nei subacquei con lo shunt grande. Il principale limite di questo studio è la piccola dimensione del campione, ma i risultati suggeriscono la necessità di ulteriori studi sulle pratiche di immersione conservativa per i subacquei con shunt da destra a sinistra.
Quando si è verificata una DCI, specialmente dopo i cosiddetti casi "immeritati" di DCI, i subacquei sono spesso incoraggiati a fare uno screening per uno shunt e alcune società mediche subacquee classificano questi subacquei come non idonei a tornare alle immersioni (rif. 15). Ci sono anche diversi medici specialisti subacquei che raccomandano che i subacquei con una storia di DCI e uno shunt destro-sinistro positivo, subiscano la chiusura se si è rivelato essere un PFO, anche se non ci sono prove chiare che indichino che questo intervento riduce il rischio di DCI o eventi neurologici (rif. 16-19). Tuttavia, in uno studio del 2011 su 83 subacquei con una storia di DCI e un follow-up di 5,3 anni, 28 subacquei non avevano PFO, 25 avevano una chiusura del PFO e 30 hanno continuato le immersioni con un PFO senza chiusura (rif. 20). All'inizio dello studio, non c'erano differenze significative tra i gruppi nel numero di immersioni, profili di immersione, profondità di immersione o immersioni cumulative a più di 40 msw (metri di acqua salata). Dopo il follow-up, mentre non c'erano differenze tra i gruppi rispetto agli eventi DCI minori, il rischio di DCI maggiore era significativamente più alto nei subacquei con PFO e senza chiusura rispetto ai subacquei con PFO e chiusura o subacquei senza PFO. Sebbene ciò offra nuove prove che la chiusura del PFO riduce il rischio di DCI maggiore, gli autori non raccomandano la chiusura del PFO a tutti i subacquei con una storia di DCI, ma piuttosto raccomandano ulteriori studi per confermare questi risultati.
Un recente studio del nostro istituto (rif. 21) finanziato dal Divers Alert Network (DAN) ha anche suggerito che subacquei selezionati con malattie da decompressione ricorrenti possono trarre beneficio dalla chiusura del PFO. Sono stati arruolati 77 pazienti con malattia da decompressione ricorrente e forame ovale pervio documentato. E’ da notare che questo non era uno studio randomizzato. I pazienti stessi hanno deciso se avere la chiusura del PFO o immergersi in modo conservativo dopo che è stata fatta la diagnosi di PFO. Questo ovviamente crea qualche pregiudizio allo studio. Dei 77 pazienti partecipanti al nostro studio 15 sono stati esclusi per vari motivi, lasciando 62 pazienti che sono stati seguiti prospetticamente per 5-6 anni. I dati demografici di base che includevano età, sesso, anni di immersione, numero totale di immersioni e numero di immersioni all'anno erano molto simili nei due gruppi, così come il numero di subacquei che hanno smesso di immergersi o si sono immersi meno dopo aver sofferto di malattia da decompressione. Una percentuale maggiore di subacquei nel gruppo "con chiusura PFO" aveva PFO "grandi". Il follow-up nel gruppo con chiusura del PFO è stato di 6anni e nel gruppo “conservativo” è stato di 5,5 anni. I 42 soggetti nel gruppo con chiusura del PFO hanno avuto un'incidenza di malattia da decompressione di 12,9 episodi per 10.000 immersioni prima della chiusura del PFO e quindi hanno avuto una riduzione statisticamente significativa (p <0,05) a 2,7 episodi per 10.000 immersioni dopo la chiusura del PFO. I 20 partecipanti al gruppo conservativo hanno avuto un'incidenza di malattia da decompressione di 13,4 episodi ogni 10.000 immersioni. Dopo 5,5 anni di immersione conservativa senza chiusura del PFO, l'incidenza della malattia da decompressione è stata di 3,4 episodi per 10.000 immersioni, ma questo non ha soddisfatto la significatività statistica dato il numero limitato di soggetti.
Chiusura percutanea del PFO
La procedura di chiusura per un forame ovale pervio è relativamente indolore e viene eseguita non chirurgicamente utilizzando un ago inserito in una vena femorale. L'imaging durante la procedura viene eseguito con una combinazione di fluoroscopia e imaging ecografico, TEE o eco intracardiaca. Il dispositivo più comune in uso negli Stati Uniti è l'Amplatzer PFO Occluder [vedi foto sotto]. Questa è una rete metallica realizzata in nichel e una lega di titanio. Il dispositivo è riempito con tessuto in poliestere saldamente cucito per aiutare a chiudere il difetto. Viene installato attraverso un piccolo catetere che è stato posizionato attraverso il PFO. La procedura dura circa un'ora e di solito i pazienti vengono dimessi lo stesso giorno o la mattina successiva. |
Conclusioni e raccomandazioni
La South Pacific Underwater Medicine Society (SPUMS), lo United Kingdom Sports Diving Medical Committee (UKSDMC) e la Undersea and Hyperbaric Medical Society (UHMS) hanno fornito delle raccomandazioni formali sul forame ovale pervio e sulla malattia da decompressione. I loro consigli sono: Non è necessario uno screening di routine per il PFO al momento della valutazione dell'idoneità medica in immersione.
La decisione di indagare se c’è il PFO
dovrebbe riguardare i subacquei con: - Storia attuale o passata di emicrania con aura - Storia dell'ictus criptogenico - Storia di PFO o ASD in un parente di primo grado
|
|
Amplatzer Cribriform Occluder |
Schema della procedura di chiusura del PFO |
Se viene eseguito lo screening: - Dovrebbe essere eseguito in centri ben pratici nella procedura. - L'eco transtoracica (TTE) con soluzione fisiologica agitata è il primo test preferito. - Devono essere eseguite manovre provocatorie (Valsalva, annusare) - In caso di test positivi: un grande shunt o uno shunt non provocato è associato a certe forme di DCI (cerebrale, spinale, orecchio interno e cutaneo). Piccoli shunt sono associati a un rischio inferiore ma scarsamente definito di DCI.
Se viene dimostrato un PFO, le opzioni includono: 1) Smetti di immergerti 2 ) mmergiti in modo più conservativo 3)Chiudi il PFO
Il subacqueo non deve tornare in immersione dopo la chiusura del PFO fino a quando non è stata confermata una chiusura soddisfacente. |
Considerazioni finali
Tutti i subacquei dovrebbero essere sottoposti a screening per un PFO?No. Il rischio relativo di DCI aumenta di circa cinque volte nei pazienti con PFO, ma il rischio assoluto è ancora piuttosto basso Tutti i subacquei con DCI dovrebbero essere sottoposti a screening per un PFO?No. Il 25% della popolazione ha un PFO, quindi ci si aspetta che una percentuale simile di subacquei con DCI abbia un PFO. Non tutte le immersioni subacquee presentano lo stesso rischio di DCI. Per parafrasare la famosa citazione di James Carville dalla prima campagna presidenziale di Clinton, "Sono le bolle, stupido". Il problema con la malattia da decompressione è il "carico di bolle" del gas inerte, non il PFO. Tuttavia, episodi di DCI in immersioni "a basso rischio" (in particolare eventi neurologici, dell'orecchio interno o "pieghe cutanee") o più eventi DCI "immeritati" dovrebbero indurre a indagare per il PFO. Tutti i subacquei con DCI e PFO dovrebbero avere una chiusura PFO?No. Le opzioni per i subacquei con PFO e DCI includono l'interruzione dell'immersione, l'istituzione di pratiche di immersione più conservative o la chiusura del PFO. Le raccomandazioni dovrebbero essere formulate caso per caso in base all'evento di DCI, al tipo di immersione che viene eseguita dal subacqueo coinvolto e ai rischi di chiusura del PFO. |
|
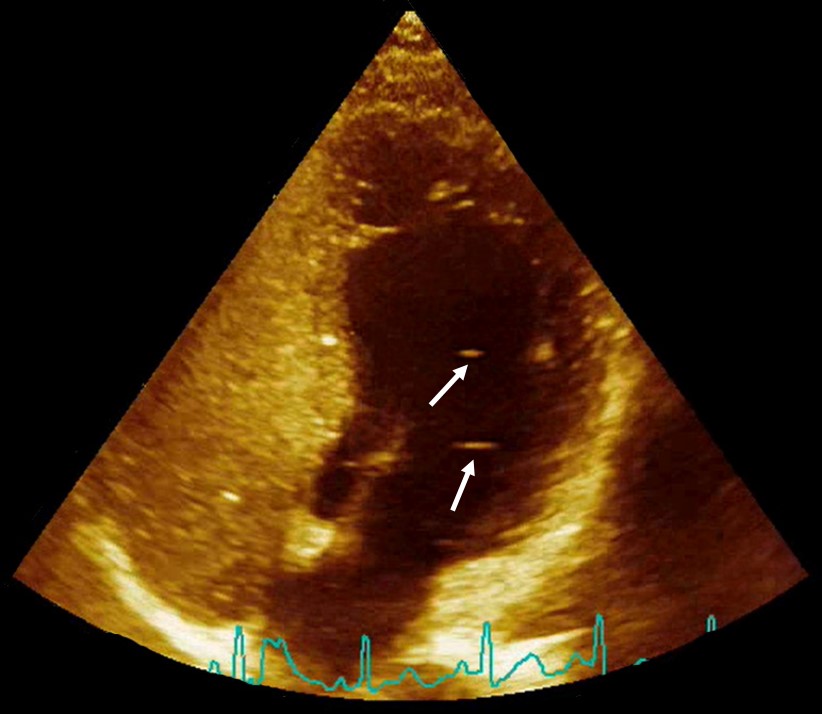
Questa è l'immagine di un cuore con un PFO. Le bolle cliniche sono
state iniettate nella vena della persona per
diagnosticare il PFO. Si vede che riempiono
completamente le camere venose (lato sinistro
dell'immagine) e poiché c'è un PFO, alcune bolle si
vedono anche nelle camere arteriose (indicato dalle
frecce bianche - probabilmente ce n'è molto di più, se
noti che il fondo del lato destro è più luminoso
rispetto al resto di quelle camere e in realtà è perché
alcune minuscole bolle stanno attraversando). (per gentile concessione di Virginie Papadopoulou).
|
Note/Riferimenti:1. Wilmshurst, PT, Byrne JC, Webb-Peploe MM. Relazione tra shunt interatriali e malattia da decompressione nei subacquei. Lancetta. 1989; 334: 1302-1306. 2. Torti SR, Billinger M, Schwerzmann M. Rischio di malattia da decompressione tra 230 subacquei in relazione alla presenza e alle dimensioni del forame ovale pervio. Eur Heart J 2004; 25: 1014-1020. 3. Bove AA. Rischio di malattia da decompressione con forame ovale pervio. Undersea Hyperb Med 1998; 25: 175-8. 4. Hagan PT, Scholz DG, Edwards WD. Incidenza e dimensione del forame ovale pervio durante i primi 10 decenni di vita: uno studio di autopsia su 965 cuori normali. Mayo Clin Proc 1984; 59: 17-20. 5. Kerut EK, Norfleet WT, Plotnick GD, Giles TD. Patent foramen ovale: una rassegna delle condizioni associate e l'impatto della dimensione fisiologica. J Am Coll Cardiol 2001; 38 (3): 613-623. 6. Wilmhurst PK, Ellis BG, Jenkins BS. Embolia gassosa paradossale in un subacqueo con un difetto del setto interatriale. Br Med J (Clin Res Ed) 1986; 293: 1277. 7. Moon RE, Camporesi EM, Kisslo JA. Forame ovale brevettato e malattia da decompressione nei subacquei. Lancet 1989; 1: 513-14. 8. Germonpre P, Dendale P, Unger P, et al. Forame ovale brevettato e malattia da decompressione nei subacquei sportivi. J Appl Physiol 1998; 84: 1622-6. 9. Germonpre P, Hastir F, Dendale P, et al. Prove per aumentare la pervietà del forame ovale pervio nei subacquei. Am J Cardiol 2005; 95; 912-15. 10. Gempp E, Blattearu J, Stephant E, et al. Relazione tra shunt destro-sinistro e malattia da decompressione del midollo spinale nei subacquei. Int J Sports Med 2009; 30: 150-3. 11. Schwerzmann M, Seiler C, LippE, et al. Relazione tra forame ovale pervio rilevato direttamente e lesioni cerebrali ischemiche nei subacquei sportivi. Ann Intern Med 2001: 134: 21-4. 12. Schuchlenz HW, Weihs W, Hackl E, Rehak P.Una grande valvola di Eustachio è un confonditore del contrasto ma non dell'ecocardiografia transesofagea color Doppler nel rilevare uno shunt da destra a sinistra attraverso un forame ovale pervio. Int J Cardiol 2006; 109: 375-80. 13. Gin KG, Huckell VF, Pollick C.L'erogazione di mezzo di contrasto nella vena femorale migliora la rilevazione ecocardiografica transtoracica del forame ovale pervio. J Am Coll Cardiol 1993; 22: 1994-2000. 14. Klingmann, C, Rathmann N, Hausmann D, et al. Minor rischio di malattia da decompressione dopo la raccomandazione di pratiche di decompressione conservativa nei subacquei con e senza shunt vascolare destro-sinistro. Medicina subacquea e iperbarica 2012; 42 (3): 146-150. 15. [Società medica svizzera subacquea e iperbarica. Empfehlungen 2007. Der Schwiezerischen Gesellschaft Fur Unterwasser-und Hyperbarmedizin Zum Tauchen Mit Einem Offenen Foramen Ovale] [citato 2012 giugno11]. Disponibile da: http://www.suhms.org/downloads/SUHMS%20PFO%20Flyer%20d.pdf(German ) 16. Scott P, Wilson N, Veldtman G. Frattura di un occlusore settale GORE HELEX a seguito della chiusura del PFO in un subacqueo. Catetere Cardiovasc Interv 2009; 73: 828-31. 17. Wahl A, Praz F, Stinimann J, Windecker S, Seiler C, Nedeltchev K, et al. Sicurezza e fattibilità della chiusura percutanea del forame ovale pervio senza ecocardiografia intra-procedurale in 825 pazienti. Swiss Med Wkly. 2008: 138: 567-72. 18. Saguner AM, Wahl A, Praz F, et al. Figulla PFO occluder contro Amplatzer PFO occluder per la chiusura percutanea del forame ovale pervio. Catetere Cardiovasc Interv 2011; 77: 709-14. 19. Furlan AJ, Reisman M, Massaro J, et al. Chiusura o terapia medica per ictus criptogenico con forame ovale pervio. N Engl J Med. 2012; 366: 991-9. 20. Billinger M, Zbinden R, Mordasini R, et al. Chiusura brevettata del forame ovale nei subacquei ricreativi: effetto sulla malattia da decompressione e sulle lesioni cerebrali ischemiche durante il follow-up a lungo termine. Cuore. 2011; 97: 1932-7. 21. Anderson G, Ebersole D, Covington D, Denoble PJ. L'efficacia degli interventi di mitigazione del rischio nei subacquei con forame ovale persistente (pervio). Diving Hyperb Med 2019 Jun 30; 49 (2): 80-8 |
|
L'Autore
|